Тонкокишечная непроходимость
Разделение ОКН на тонкокишечную и толстокишечную и выявление таких разновидностей как высокая и низкая тонкокишечная непроходимость, несмотря на некоторую условность, имеет отчетливо выраженное практическое значение.
Каждый из упомянутых видов и разновидностей ОКН отличается по основным причинам формирования механического препятствия, по остроте и выраженности клинических проявлений, по характеру наиболее возможных последствий и осложнений, определяющих жизненную угрозу. Различия в патологических механизмах и в клинических проявлениях вполне естественно влекут за собой и различия в лечебной тактике, которые необходимо правильно учитывать при организации лечебного процесса.
Тонкокишечной непроходимости свойственны все указанные выше варианты формирования механического препятствия, связанные с эластическим ущемлением сегмента кишки, ограничением подвижности или, наоборот, избыточной подвижностью на длинной брыжейке отдельных ее участков, обтурацией просвета. При этом частота возникновения конкретных причин непроходимости в различных отделах тонкой кишки неодинакова.
Так, проксимальные отделы тонкой кишки (условно — до границы между тощей и подвздошной кишкой) вообще относительно реже являются местом формирования механического препятствия. По данным ВМА, из 978 наблюдений кишечной непроходимости механическая тонкокишечная непроходимость встретилась в 86,6 % случаев, толстокишечная (неопухолевого генеза) — в 10,8 %, а динамическая ОКН — в 2,6 %.
Если выделить в этой общей структуре отдельно высокую и низкую механическую тонкокишечную непроходимость, то первая составила всего 12,1 %, а вторая — 74,5 %. Таким образом, высокая механическая тонкокишечная непроходимость по частоте лишь немногим превышает толстокишечную непроходимость неопухолевого генеза.
Видимо, такое положение определяется большей подвижностью дистальной части тонкой кишки, свободно располагающейся в нижних отделах брюшной полости, более сложных по своему строению. Частое развитие низкой тонкокишечной непроходимости объясняется также наличием грыж брюшной стенки и последствиями хирургических вмешательств, чаще выполняемых в этой зоне (аппендэктомия, вмешательства на гениталиях и др.) в неотложном порядке.
Например, такая причина формирования механического препятствия, как ущемление кишки в наружной грыже живота, по нашим данным, почти в 12 раз чаще ведет к развитию низкой тонкокишечной непроходимости, чем высокой. Спаечная тонкокишечная непроходимость в 72,3 % наших наблюдений была связана с формированием механического препятствия в подвздошной кишке, что позволяло говорить о низкой тонкокишечной ОКН. Подвздошная кишка чаще вовлекается в узлообразование, а илеоцекальный угол — одна из характерных локализаций инвагинации.
Напротив, такие причины формирования препятствия, как сдавление просвета кишки, расположенной за-брюшинно, сосудами корня брыжейки, заворот удлиненной брыжейки под влиянием моторной гиперфункции или при повышении внутрибрюшинного давления (в условиях общего висцероптоза), влекут за собой развитие высокой тонкокишечной непроходимости. Высокая непроходимость чаще оказывается следствием внутренней обтурации просвета тонкой кишки фито- или трихобезоарами, какими-либо инородными телами или желчными камнями.
По нашим наблюдениям, развитие высокой тонкокишечной непроходимости чаще оказывалось связанным и с такой редкой причиной формирования морфологического субстрата ОКН, как внутренние мезентерико-париетальные грыжи.
Таким образом, выявление признаков высокой или низкой тонкокишечной непроходимости может дать ориентировочное представление о возможных ее причинах.
Особенности патогенеза и клинических проявлений
В развитии как высокой, так и низкой тонкокишечной непроходимости участвуют все компоненты патогенеза, однако роль их неоднозначна. Это прежде всего определяется различной функцией тощей и подвздошной кишки.
В тонкой кишке осуществляется первичный контакт с организмом поступивших в желудочно-кишечный тракт антигенов, сохранивших свои свойства после воздействия кислого желудочного содержимого. Основная часть клеток Панета, выделяющих лизоцим, располагается в тощей кишке и определяет возможности неспецифической антимикробной защиты . По данным ряда авторов, тощая кишка является основным источником лизоцима в организме. Лимфоциты в тощей кишке представлены преимущественно В-клетками, продуцирующими IgA и IgE [Shorter R., 1985]. Таким образом, гуморальная секреторная иммунная система слизистой оболочки сосредоточена главным образом в тощей кишке/
В подвздошной кишке пищеварительная функция постепенно уступает место резорбтивной, хотя в отношении ряда продуктов [аминокислот, углеводов] последняя интенсивно проявляется уже в верхних отделах. Постепенная резорбция воды и солей изменяет консистенцию содержимого дистальных отделов тонкой кишки, делает его в нормальных условиях более густым. В этих отделах кишечника вегетирует более обильная и разнообразная по своему составу микрофлора. В ней увеличивается доля анаэробных микроорганизмов.
Микрофлора все более приближается к толстокишечной. В дистальных отделах тонкой кишки сосредоточены, специфические лимфоидные образования — пейеровы бляшки и солитарные фолликулы, содержащие Т-лимфоциты. Эти же клетки составляют основную массу лимфоцитов в стенке подвздошной кишки. Все это характеризует дистальные отделы тонкой кишки как основную «лабораторию» клеточных механизмов секреторного иммунитета пищеварительного тракта.
Развитие высокой тонкокишечной непроходимости уже на ранних этапах сопровождается бурной функциональной реакцией. Перерастяжение проксимальных отделов кишечника вызывает раздражение двигательного и секреторного аппаратов. Появляется интенсивная перистальтика в расположенных выше отделах, которая при наличии неустраненного препятствия быстро переходит в антиперистальтику, что сочетается с рефлекторным расслаблением проксимальных мышечных сфинктеров. Возникает мучительная обильная рвота, которая поддерживается реактивным увеличением секреции в проксимальных отделах кишечной трубки. Нередко одновременно наблюдается и рефлекторное усиление перистальтики дистальных отделов кишечника, что обусловливает императивное их опорожнение, несмотря на наличие механической кишечной непроходимости. Этот феномен при высокой механической ОКН наблюдали у больных. В дальнейшем в связи с недостаточной декомпрессией проксимальных отделов только за счет рвоты кишечные петли выше уровня препятствия перерастягиваются, питание их стенки ухудшается, что вызывает угнетение двигательной и секреторной функции, увеличение фильтрации жидкости в просвет кишки и снижение ее реабсорбции. Порочный круг патогенеза ОКН замыкается. При этом основная роль в патогенезе тяжелых общих расстройств при высокой тонкокишечной непроходимости принадлежит нарушениям внутренней среды организма, связанным с возрастающими потерями воды, электролитов, ферментативных белков и с изменениями КОС. Иногда при обильной рвоте в крови определяется декомпенсированный алкалоз, требующий специальной коррекции [Рябов Г. А. и др., 1983].
Эндотоксикоз и обусловленные им вторичные нарушения системного метаболизма также имеют место при высокой тонкокишечной непроходимости, однако значение их в патогенезе расстройств несколько уступает нарушениям внутренней среды вследствие прямых потерь всех ее компонентов через просвет проксимальных отделов пищеварительной системы. Это проявляется и клинически. При высокой непроходимости раньше появляются признаки гипогидратации: «заостряются» черты лица, снижается тургор покровных тканей, отмечается сухость слизистой оболочки, жажда. Мучительные позывы на рвоту, не приносящую облегчения, сопровождаются постепенным увеличением объема рвотных масс. В них отмечается примесь желчи, содержимого проксимальных отделов тонкой кишки, много слизи. В дальнейшем рвотные массы приобретают застойный, все более патологический характер.
Из 130 наблюдавшихся и больных, у которых механическое препятствие локализовалось в тощей кишке, рвота наблюдалась у 117, причем у 96 носила многократный характер. У 62 больных этой группы, несмотря на наличие непроходимости, отмечались позывы на стул, отходили газы и жидкое кишечное содержимое. У 57 больных лейкоцитоз превышал 12· 109/л, что расценивали как следствие сгущения крови на фоне гипогидратации.
Несколько иная «программа» развития патологического процесса и динамика клинических проявлений свойственны низкой тонкокишечной непроходимости. Здесь на раннем этапе на первый план выступает болевой синдром, характер и интенсивность которого зависит от конкретной морфологической формы острой кишечной непроходимости (странгуляция, инвагинация, заворот и др.). Рвота, если она возникает на ранних этапах, носит рефлекторный характер и бывает чаще однократной.
При развившейся острой низкой тонкокишечной непроходимости ведующую роль приобретает прогрессирующий эндотоксикоз.
В дальнейшем по мере наступления ишемической деструкции тканевых структур кишечной стенки снижается ее барьерная функция, усиливается патологическая вегетация микрофлоры в содержимом и включаются аутокаталитические механизмы эндотоксикоза. Таким образом, в генезе системных метаболических расстройств и общих клинических проявлений при низкой тонкокишечной непроходимости на передний план более отчетливо выдвигается эндогенная интоксикация.
Вполне естественно, что в поздней стадии процесса независимо от уровня механического препятствия оба патологических компонента сочетаются и взаимно дополняют друг друга.
Особенности лечебной тактики при высокой и низкой тонкокишечной непроходимости
При высокой тонкокишечной непроходимости, обусловленной функциональной декомпенсацией проксимальных отделов на фоне длительно существующего спаечного процесса, вполне обосновано проведение консервативных лечебных мероприятий, направленных на декомпрессию кишки выше уровня препятствия. Такая декомпрессия устраняет нарушения внутристеночной гемоциркуляции и способствует восстановлению функции кишки.
Полезным в этом отношении мероприятием, в котором сочетаются эффективная диагностика непроходимости и патогенетическое лечебное пособие, является энтерография. Приводим следующее наблюдение.
Больной Т., 35 лет, поступил в клинику с жалобами на схваткообразные боли в животе, тошноту, рвоту. Отмечалась задержка стула и газов. В детском возрасте перенес осколочное проникающее ранение живота с эвентрацией кишечной петли.
Живот умеренно вздут, болезнен в области старого послеоперационного рубца. В горизонтальном положении больного над верхними отделами живота определялся тимпанит. При аускультации кишечные шумы не выслушивались, слева от рубца в подреберной области воспроизводился шум плеска.
При обзорной рентгенографии брюшной полости в отдельных петлях тонкой кишки, преимущественно в левом верхнем отделе брюшной полости обнаружено небольшое количество газа и жидкости. Газ выявлен и в толстой кишке.
Недостаточно отчетливые клинические и рентгенологические данные побудили хирургов выполнить зондовую энтерографию с одновременной декомпрессией тонкой кишки. Через назогастральный зонд, проведенный за связку Трейтца, удалено около 500 мл жидкого кишечного содержимого с примесью желчи и введено 1000 мл 20 % бариевой взвеси, приготовленной на изотоническом растворе хлорида натрия. На рентгенограмме, выполненной через 10 мин, выявлено конусовидное сужение тощей кишки в левой верхней части брюшной полости. Проксимальные петли кишки расширены, рельеф складок свидетельствовал об отеке слизистой оболочки (рис.).
Проведена повторная декомпрессия проксимальных отделов тонкой кишки. Удалено более 800 мл жидкости и взвеси бария. Состояние больного улучшилось сразу же после завершения процедуры. Боли уменьшились. При контрольной рентгенографии брюшной полости отмечено значительное уменьшение ширины кишечных петель, однако существенного продвижения контрастной массы по кишечнику не наблюдалось.
Через тот же зонд в тощую кишку введено под давлением еще 500 мл 20 % взвеси бария. На рентгенограмме, выполненной через 1 ч 20 мин, большая часть контрастного вещества находилась в толстой кишке .
Отмечена выпрямленность отдельных петель тонкой кишки, что свидетельствовало о спаечном процессе. Через 5 сут больной был выписан из клиники без операции.
В данном наблюдении применение зондовой энтерографии с повторной декомпрессией тонкой кишки над уровнем препятствия позволило распознать уровень механической непроходимости тонкой кишки, определить характер патологического процесса и добиться разрешения высокой острой тонкокишечной непроходимости, наступившей вследствие грубого нарушения пищевого режима, консервативным путем. Возможность достижения подобного эффекта обусловлена патологическими особенностями высокой тонкокишечной непроходимости, которые были представлены ранее.
При низкой механической тонкокишечной непроходимости рассчитывать на полноценную декомпрессию всего проксимального отдела кишечной трубки с помощью зонда, введенного в начальный отдел тощей кишки, трудно. В связи с этим приостановленном диагнозе низкой тонкокишечной механической непроходимости задержка операции с целью проведения консервативны мероприятий не оправдана и может привести к ишемической деструкции кишечной стенки в зоне непроходимости. Сроки такой деструкции определяются конкретной морфологической формой непроходимости (преобладанием странгуляционного или обтурационного компонентов в формировании препятствия) и исходным функциональным состоянием микроваскулярного ложа тонкой кишки. Значительные потери воды, электролитов и белков, изменение КОС внутренней среды организма, сопровождающие высокую тонкокишечную непроходимость, обусловливают проведение специальной коррекции и в предоперационном и послеоперационном периоде.
Наряду с полноценной инфузионной терапией комплексное лечение низкой тонкокишечной непроходимости включает в себя проведение специальных мероприятий по детоксикации организма. Среди современных методов, используемых для детоксикации, при лечении запущенных форм низкой тонкокишечной непроходимости, сопровождавшихся развитием перитонита, используют гемосорбцию, лимфосорбцию и энтеросорбцию.
Гемосорбцию проводят с помощью аппарата УЭГ-1, трансфузионного аппарата AT или других аппаратов аналогичного назначения. Используют стандартные углеродные гемосорбенты СКН серий 2М, ЗМ, 4М, 1К [Лопухин Ю. М., Молоденков М. Н., 1985]. Перед началом сорбции флакон с сорбентом промывают 400 мл изотонического раствора хлорида натрия с добавлением 10 000 ЕД гепарина и заполняют 200 мл 10 % плацентарного альбумина. В большинстве случаев гемосорбцию проводят вено-венозным способом с забором крови из подключичной вены и возвратом ее в одну из периферических вен. У больных с катетеризацией брюшной аорты кровь забирают из катетера и возвращают в подключичную вену. Скорость перфузии составляет 80—120 мл/мин, продолжительность сеанса — 90- 120 мин.
В последние годы использовали гемосорбцию лишь у больных с ОКН, оперированных на фоне развившегося разлитого перитонита с признаками выраженного эндотоксикоза. Помимо общеклинических и биохимических лабораторных показателей, об эффекте гемосорбции судили по снижению уровня эндотоксемии, определяемого с помощью биологического теста с простейшими.
В последнее десятилетие в лечении эндогенной интоксикации, обусловленной печеночно-почечной недостаточностью, механической желтухой, гнойным перитонитом, острой кишечной непроходимостью, деструктивным панкреатитом и другими заболеваниями, широко стали применять метод экстракорпоральной детоксикационной лимфосорбции.
Лимфатическая система при воспалении имеет особое значение не только в поддержании водного равновесия, но и в удалении микроорганизмов, патологических агентов из очага воспаления, токсических метаболитов и клеточных остатков. Лимфа обладает высокой ферментативной активностью, принимает активное участие в резорбции и транспорте мочевины, билирубина, креатинина. Токсические вещества скапливаются в больших количествах в межклеточном пространстве в результате нарушения микроциркуляции, что обусловливает нарастание общей эндогенной интоксикации. При разгрузке лимфатической системы путем дренирования грудного протока улучшается микроциркуляция и осуществляется удаление токсических веществ из межклеточных пространств и очага воспаления.
Для обнаружения и дренирования терминального отдела грудного протока чаще всего применяют горизонтальный доступ в левой надключичной ямке. Используют управляемый лимфоток, что позволяет регулировать объем суточной лимфопотери. В первые 4—5 суток ввиду высокой токсичности выделение лимфы поддерживают непрерывным. В качестве лимфосорбента используют хорошо зарекомендовавшие себя азотсодержащие активные угли марки СКН. Количество выделяющейся лимфы в среднем составляет 2—3 л в сутки. Применяя лимфостимуляцию, нам удавалось получать по 4—5 л, достигая этим более выраженный детоксикационный эффект.
Мы использовали у 65 больных различные способы очищения лимфы — рециркуляционный, капельный, статический и лимфаферез.
При рециркуляционном способе лимфу собирают во флакон и с помощью роликового насоса для перфузии жидкостей (можно использовать аппарат для перфузии крови AT-196) пропускают через колонку с сорбентом со скоростью 60—80 мл/мин и обратно возвращают в первый флакон. Время сорбции составляют 20— 30 мин.
При капельном методе собранную во флакон с антикоагулянтом лимфу пропускают через колонку с сорбентом и сразу же реинфузируют внутривенно. Скорость реинфузии лимфы должна быть такой же, как и при поступлении ее из грудного протока во флакон сбора.
При статическом способе в собранную лимфу добавляют сорбент. Сорбцию осуществляют периодическим переворачиванием флакона лимфы с сорбентом в течение времени, необходимого для заполнения лимфой другого флакона. Обычно при хорошей лимфорее это составляет 2—3 ч. При проведении лимфафереза собранную во флакон лимфу (с помощью рефрежераторной центрифуги при 1500 об/мин в течение 20 мин) разделяют на лимфоконцентрат, состоящий из форменных элементов, и лимфоплазму. В дальнейшем лимфоплазму пропускают через колонку с сорбентом, соединяют с ранее отделенными лимфоцитами и реинфузируют внутривенно.
Для применения каждого способа лимфосорбции имеются свои показания. Рециркуляционный способ используют при длительно сохраняющейся высокой токсичности лимфы; при нормальных или незначительно сниженных показателях иммунной системы. Капельный способ показан при вялотекущем общем перитоните или отграниченных его формах; недостаточном лимфооттоке (1 л и менее за сутки); нормальных или незначительно сниженных показателях иммунной системы: предполагаемом непродолжительном сроке лимфосорбции; имеющихся признаках сердечно-легочной недостаточности.
Статический способ применяют при необходимости проведения длительной лимфосорбции; высокой токсичности лимфы. Лимфаферез используют при исходной лейко- и лимфопении; высокой токсичности лимфы; исходном дефиците иммунных показателей.
Перечисленные показания к выбору способа детоксикации не рассматривают как абсолютные и постоянные. При изменении условий (общее состояние больного, течение заболевания) можно переходить от одного способа к другому или к их комбинациям.
Положительный эффект достигается при применении всех методов лимфоочищения, однако при статическом, рециркуляционном и капельном способах на углях оседает или разрушается до 30 % лимфоцитов, причем в большей мере страдают молодые клетки. На 3-и сутки лимфосорбции уменьшается количество Т-лимфацитов в 2 раза, В-лимфоцитов в 5 раз. При лимфаферезе эти изменения наблюдаются в значительно меньшей степени и наступают гораздо позже. Так, количество Т-лимфоцитов снижается лишь в 2 раза и только через 12 дней, В-лимфоцитов через 8 дней. Это позволяет использовать лимфаферез более длительное время — до 2 нед.
Эффективность детоксикации лимфы оценивают по динамике содержания различных метаболитов. Достаточно информативным являются показатели билирубина, креатинина и азота мочевины. По нашим данным, снижение их отмечено соответственно на 77; 78,5 и 95 %.
Важное значение в определении токсичности лимфы придают парамецийному тесту и определению уровня средних молекул (методом спектрофотометрии). При исследовании парамецийного теста определяют продолжительность жизни простейших (парамеций), которая зависит от токсичности лимфы. Определение уровня средних молекул также имеет важное значение, так как они включают в себя пептиды с молекулярным весом от 500 до 5000, которые обладают отчетливо выраженной токсичностью.
По нашим данным при всех методах лимфосорбции степень токсичности по парамецийному тесту снижалась от 37,3 % до 58,6 %, по уровню средних молекул — от 32,7 до 51,4%. Лучше результаты детоксикации лимфы по обоим тестам получены при статическом методе лимфосорбции.
Устранение главного источника эндогенной интоксикации при ОКН — застоя кишечного содержимого — предствляет особенно важную задачу при низкой тонкокишечной непроходимости, когда в процесс вовлекается вся тонкая кишка. В этом отношении особое место принадлежит продолженному пассивному дренированию кишечной трубки в послеоперационном периоде.
Показания к дренированию следующие:
1) перерастяжение петель тонкой кишки выше уровня механического препятствия на фоне развития пареза кишечника с признаками микроциркуляторных нарушений в его стенке;
2) выраженный распространенный спаечный процесс в брюшной полости, когда для надежного устранения непроходимости требуется рассечение множества спаек (особенно у больных, неоднократно оперированных по поводу спаечной ОКН).
В первом случае дренирование преследует цель удаления скапливающегося в просвете тонкой кишки токсичного кишечного содержимого и декомпресии кишки для восстановления гемоциркуляции в ее стенке. Во втором случае, кроме этих целей, интубацию кишки производят для создания каркаса, на котором кишечные петли последовательно укладываются в положении, не препятствующем их проходимости при условии возникновения повторного спаечного процесса. Расчет ведется на фиксацию кишечных петель в функционально более выгодном положении по типу операции Нобля или Блинова.
Продолженное дренирование кишечной трубки в послеоперационном периоде в соответствии с представленными показаниями мы осуществили у 264 больных. У 185 выполнили энтеростомию по Житнюку, у 15 ретроградную интубацию проводили через слепую кишку, у 39 выполнили гастроэнтеростомию по Дедереру и у 25 — дренирование тощей и подвздошной кишки с помощью назогастроинтестинального зонда. При этом у большинства больных (176) интубацию тонкой кишки производили только с целью ее декомпрессии и устранения эндотоксикоза (65,9%), у 14 (5,2%) больных трубку вводили для обеспечения «каркасной» функции и у 74 (28,8 %) больных эти задачи сочетались.
Стремясь избежать нежелательных последствий длительного пребывания резиновой или силиконовой трубки в тонкой кишке, было предложено при лечении спаечной кишечной непроходимости вводить в кишку растворимую трубку из синтетического белка. Такая трубка действует в течение 4 дней, после чего рассасывается. При лечении 52 больных получены хорошие результаты.
Сравнивать эффективность отдельных методов дренирования нецелесообразно ввиду значительного несоответствия количественного и качественного состава отдельных групп больных. Частота использования отдельных методов зависит от конкретных показаний и условий, складывающихся на операции, материального обеспечения (наличие специальных зондов для гастроинтестинального дренирования), наконец, от личной приверженности хирурга к тому или иному методу.
Однако у всех предложенных методов есть существенный недостаток: связанная с ними детоксикация зависит лишь от эффективности дренажа. В то же время эффективность сорбционных методов детоксикации связана с целенаправленной элиминацией токсических продуктов из кишечного содержимого.
Уменьшения токсичности кишечного содержимого, а в связи с этим и снижения эндотоксикоза, можно добиться с помощью коллоидных сорбентов, которые вводят через дренажные трубки в кишечник в ранние сроки после операции, т. е. тогда, когда возникает особая потребность в проведении детоксикационной терапии. С этой целью применяют энтеродез — препарат, разработанный на основе низкомолекулярного поливинилпирролидона для приема внутрь.
Механизм действия поливинилпирролидона основан на способности образовывать с токсинами, в том числе кишечными, нетоксичные или малотоксичные комплексы [Гольбадамова И. М. и др., 1966; Фром А. А. и др., 1968; Шиманко И. И. и др., 1984]. По данным указанных авторов, разовая доза препарата при приеме внутрь составляет 5 г, а лечебный эффект проявляется через 15—30 мин после приема.
Метод энтеросорбции был использован в клинике при лечении 25 больных с различными формами острой тонкокишечной непроходимости, у которых в послеоперационном периоде осуществляли продолженное дренирование тонкой кишки на всем ее протяжении [Штрапов А. А., Рухляда Н. В., 1986]. У 10 больных дренирование тонкой кишки производили по Житнюку, у 3 — по Дедереру и у 12 — с помощью назогастроинтестинального зонда. Для энтеростомии по Житнюку применяли специальную двухпросветную трубку, позволявшую вводить препарат непосредственно в проксимальные отделы тонкой кишки.
Методика энтеросорбции заключается в следующем. Непосредственно перед использованием готовят 5 % раствор энтеродеза и вводят его в просвет кишки. Интубационную трубку пережимают на 30 мин и затем открывают на свободный отток. Процедуру повторяют 3 раза в сутки. Суточная доза препарата для одного больного составляет в среднем до 60 г.
Помимо энтеросорбции, комплексное лечение эндотоксикоза включало многокомпонентную инфузионную терапию, применение антибиотиков, по показаниям — антикоагулянтов (гепарин).
О снижении токсемии в результате энтеросорбции судили по определению биологической токсичности крови на основе тестов с простейшими (тетрахимены). Общие результаты лечения оценивали по клиническим и лабораторным данным в сравнении с таковыми аналогичной группы больных, которым проводили комплексное лечение без энтеросорбции.
По данным клинического наблюдения, после энтеросорбции отмечено уменьшение проявлений эндогенной интоксикации, раньше восстанавливалась моторная функция кишечника, улучшалось состояние гемодинамики и функции внешнего дыхания.
Приводим следующее наблюдение.
Больной Н., 50 лет, поступил в хирургический стационар 2.02.85 г. спустя 7 ч от начала заболевания с жалобами на схваткообразные боли в животе, многократную рвоту, неотхождение стула и газов.
Состояние больного тяжелое. Пульс свыше 100 в 1 мин. Язык сухой. Живот вздут, асимметричен. Перитонеальные симптомы положительные. Перистальтические шумы не выслушивались, определялся шум плеска в кишечнике. На обзорной рентгенограмме брюшной полости множественные чаши Клойбера в тонкой кишке.
После кратковременной предоперационной подготовки с диагнозом «острая кишечная непроходимость» больной оперирован. Причиной непроходимости явились спайки тонкой кишки, складывающие ее в виде нескольких двустволок на расстоянии 1 м от илеоцекального угла. Спайки рассечены. С декомпрессивной и каркасной целью тонкая кишка интубирована двухпросветной трубкой по методике Житнюка. Послеоперационный диагноз: острая спаечная тонкокишечная непроходимость, разлитой серозный перитонит.
В послеоперационном периоде больному проводили комплексное лечение, включая внутрикишечное введение энтеродеза в течение 4 сут. Явления перитонита купированы к концу 3 сут, появилась нормальная перистальтика. После заживления раны вторичным натяжением вследствие нагноения больной выписан на амбулаторное лечение с нормальной функцией кишечника.
Применение препарата не вызвало побочных неблагоприятных эффектов при использовании его с помощью дренажной трубки и обратном выведении через дренаж после непродолжительной экспозиции в просвете кишки. Это позволило нам у 3 больных с резко выраженными проявлениями эндотоксикоза увеличить дозу препарата вдвое, что усиливало эффект детоксикации, не приводя к негативным последствиям.
Приводим следующее наблюдение.
Больной С., 53 лет, поступил с жалобами на схваткообразные боли по всему животу, неукротимую рвоту, задержку стула и газов спустя 24 ч от начала заболевания. По клиническим и рентгенологическим данным была диагностирована острая кишечная непроходимость с явлениями перитонита.
После двухчасовой предоперационной подготовки больной оперирован. Установлено, что причиной острой кишечной непроходимости было ущемление подвздошной кишки в брюшинном кармане у связки Трейтца. Непроходимость устранена, брюшная полость санирована и дренирована. С декомпрессивной целью наложена гастростома в модификации Дедерера. Послеоперационный диагноз: ущемленная внутренняя грыжа с ущемлением подвздошной кишки. Разлитой фибринозно-гнойный перитонит, токсическая фаза.
В связи с выраженной интоксикацией доза энтеродеза была увеличена до 10 г на введение 3 раза в день в течение 4 дней. Острые явления перитонита и интоксикации купированы к началу 4 сут., к этому же времени начала восстанавливаться функция кишечника. Послеоперационный период протекал без осложнений, гастростома закрылась самостоятельно в течение 10 дней. На 20-е сутки больной выписан на амбулаторное лечение в удовлетворительном состоянии.
Определение уровня токсемии выявляло снижение ее через час после энтеросорбции. Среднее время гибели простейших увеличивалось более чем на 13%, а при применении двойных доз препарата — на 31 %. В целом энтеросорбция представляет один из перспективных методов детоксикации в лечении острой кишечной непроходимости.
Важным компонентом лечения тонкокишечной ОКН является предотвращение и лечение инфекционных осложнений. Эта задача особенно актуальна при низкой тонкокишечной непроходимости, поскольку в подвздошной кишке в условиях ишемии и пареза создаются благоприятные условия для вегетации патогенной анаэробной микрофлоры.
С этой целью при тонкокишечной непроходимости применяют внутриаортальные инфузии с антибиотиками в сочетании с препаратами, улучшающими реологию крови (реополиглюкин) и, функцию микроваскулярного ложа (трентал, компламин). Это способствует доставке антибиотиков в ткани кишечной стенки и обеспечению более эффективного превентивного антибактериального эффекта.
Использование этого метода в последние годы более чем в 20 наблюдениях при лечении наиболее тяжелых форм ОКН подтвердило его практическую целесообразность.
Катетеризацию аорты осуществляют через одну из бедренных артерий по Сельдингеру. Конец катетера устанавливают на уровне XI—XII грудного позвонка. Внутриаортальные инфузии можно проводить непосредственно из флаконов (с помощью аппарата AT-196 или через систему при закреплении флакона на высоте 3,5- 4 м), а также с помощью шприца. Скорость инфузии составляет 10—75 мл/мин. После завершения инфузии в катетер устанавливают «гепариновый замок». Суточный объем внутриаортальных инфузий может составить до 50—60 % общего объема вливаний. В состав инфузата вводят: низкоконцентрированные солевые растворы, 5 % раствор глюкозы, спазмолитические препараты (2 мл компламина с 4 мл но-шпы; эуфиллин до 20 мл 2,4 % раствора), препараты, улучшающие реологию крови (5 мл трентала, 400 мл реополиглюкина), антибиотики широкого спектра, предназначенные для внутривенного введения, протеин, альмубин, гемодез. Продолжительность лечения 5—8 сут.
Еще одной общей задачей лечения больных с различными видами тонкокишечной непроходимости в послеоперационном периоде является восстановление собственной моторной функции тонкой кишки. Это осуществляется с помощью различных методов. Наиболее эффективной обоснованно считают длительную перидуральную анестезию. Мы использовали ее у 188 больных с тонкокишечной непроходимостью с хорошим эффектом.
Постановку катетера осуществляют в 1—2-е сутки после операции, а в тех случаях, когда не производят резекцию тонкой кишки и не требуется ее интубация, катетер ставят в перидуральное пространство на операционном столе.
Пункция перидурального пространства производят па уровне VII—VIII грудных позвонков, чтобы обеспечить распространение анестетика на V—IX грудные сегменты и добиться блокады корешков, формирующих внутренностные нервы.
Под местной анестезией 0,25—0,5 % раствором новокаина (10— 15 мл) пункционную иглу вводят в перидуральное пространство, после чего через иглу кверху на высоту одного-двух позвонков вводят фторопластовый катетер. Убедившись в свободном поступлении анестетика, катетер фиксируют подшиванием к коже и выводят на уровень надплечья, закрепив полоской лейкопластыря. Канюлю иглы закрывают заглушкой. Введение анестетика в перидуральное пространство начинают с пробной дозы, составляющей половину разовой лечебной дозы препарата. При отсутствии гипотонии и других гемодинамических изменений в ответ на введение «пробной дозы» переходят к регулярному четырех- или восьмикратному введению лечебных доз препарата (тримекаин, лидокаин в стандартных дозировках).
У абсолютного большинства больных (77,8%). обезболивающее действие начинается через 15—20 мин после введения и сохраняется на протяжении 1,5—2,5 ч. При отсутствии прогрессирующего перитонита перистальтика кишечника восстанавливается в среднем через.12—20 ч после начала лечения, что по срокам в 2 раза быстрее, чем в аналогичных наблюдениях без использования длительной перидуральной анестезии.
Резекция кишки в лечении тонкокишечной непроходимости
Резекция тонкой кишки как компонент оперативного вмешательства при острой кишечной непроходимости заслуживает особого рассмотрения. Многие вопросы, связанные с этим этапом, остаются сложными и не получили еще своего окончательного разрешения.
Прежде всего это относится к трудностям определения жизнеспособности кишки и объема ее резекции. На эти трудности указывали многие хирурги. С неправильной оценкой жизнеспособности кишки и неадекватным вследствие этого определением объема резекции связаны многие послеоперационные осложнения при ОКН и прежде всего несостоятельность швов анастомозов.
Наиболее распространенные критерии определения жизнеспособности кишки — пульсация сосудов брыжейки, наличие перистальтики кишки, цвет серозного покрова — нельзя считать достоверными даже при наблюдении в течение нескольких минут в условиях согревания сомнительной кишки салфетками, смоченными теплым стерильным раствором. В литературе представлены многочисленные наблюдения, когда внешние признаки относительного благополучия сочетались с обширным некрозом слизистой оболочки.
Не привело к существенному улучшению положения применение функциональных, медикаментозных проб [Иванов В. В., 1966] или введения в сосудистое русло красителей. В связи с этим в неотложной абдоминальной хирургии существует правило, диктующее необходимость выполнения резекции кишки не только в случае ее явной нежизнеспособности, но и при обоснованных сомнениях в ее жизнеспособности [Норенберг-Чарквиани А. Е., 1956; Стручков В. И., 1981, и др.]. Это правило применимо, когда речь идет о резекции относительно небольшого участка кишки без тяжелого разлитого перитонита у больного с сохраненными компенсаторными резервами. Если же вопрос стоит об обширной или субтотальной резекции тонкой кишки, да еще у пожилого ослабленного больного, то при отсутствии безусловных признаков необратимых изменений в кишечной стенке риск выполнения такого пособия нередко конкурирует с риском выжидательной тактики. В подобной ситуации в некоторых, особенно зарубежных работах, рекомендуется тактика запланированной релапаротомии через 10—12 ч («Second look operation»), во время которой изменения в кишке оценивают с большей достоверностью.
В. М. Буянов и др. (1984) с этой целью используют лапароскопию через специально оставляемую в брюшной стенке металлическую гильзу.
Не менее сложным, чем установление показаний к резекции кишки, является вопрос об определении границ резекции. Даже небольшие изменения в состоянии микроваскулярного ложа кишечной стенки могут решающим образом неблагоприятно сказаться на заживлении межкишечного соустья. В настоящее время для профилактики несостоятельности шва анастомоза при некрозе кишки большинство авторов рекомендуют производить резекцию, отступя 30—40 см в проксимальном направлении и 15—20 см в дистальном [Румянцева В. В., 1958; Астапенко В. Г., Максимов С. С., 1982; Савельев В. С. и др., 1986, и др.]. При небольших по объему резекциях в среднем отделе тонкой кишки выполнение этого правила в большинстве случаев не вызывает затруднений. Однако, когда речь идет об обширных и субтотальных резекциях тонкой кишки или когда резекцию необходимо производить в непосредственной близости от илеоцекального угла, могут возникнуть значительные трудности. Тогда методы объективной оценки состояния внутристеночного кровотока приобретают особое значение. Одним из таких методов, доступность и практическая рациональность которого получала подтверждение в последние годы, является метод трансиллюминационной тензометрии, предложенный в 1971 г. 3. М. Сигалом. Мы применяем модифицированный метод Сигала, используя источник холодного света, что упростило подготовку прибора к работе и повысило объективность результатов исследования [Ерюхин и др., 1982].
Аппарат состоит из трех основных узлов (рис.): I — рабочая головка; II — система подсветки; III — система регулируемого давления.
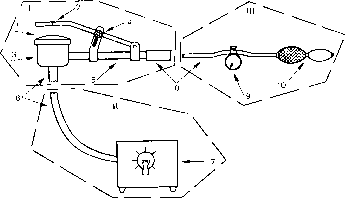
Рис. Схема устройства для трансиллюминационной тензометрии. Объяснение в тексте.
Рабочая головка прибора представляет собой цилиндр (3), покрытый сверху тонкой резиновой мембраной (1). Сбоку к цилиндру припаяна трубка (5), на которой укреплена прижимная рабочая бранша со стеклом (2). Для установления бранши в определенном положении имеется фиксатор (4). К нижней части цилиндра фиксируется стекловолоконный световод (6) от источника света (7). В качестве последнего можно использовать аппарат ОС-100. С помощью резиновой соединительной трубки(8) рабочая головка аппарата соединяется с системой давления, состоящей из манометра с краном для снижения давления (9), шкала которого градуирована в миллиметрах ртутного столба, и резиновой груши для нагнетания воздуха — баллон Ричардсона (10). Все части аппарата, соприкасающиеся с операционным полем, легко стерилизуются погружением на 4—5 мин в раствор первомура.
Для выполнения ангиотензометрии исследуемый участок кишки помещают противобрыжеечным его краем между прижимной браншей и цилиндром с мембраной. Стекло с браншей опускают на стенку кишки до плотного соприкосновения и фиксируют в таком положении. Включают подсветку. По мере нагнетания воздуха давление в камере повышается, а кровь вытесняется из венозных и артериальных сосудов кишечной стенки. При постепенном снижении давления сосуды начинают медленно наполняться. Появление первой пульсовой волны соответствует систолическому давлению, а прекращение видимой пульсации артериальных сосудов — диастолическому. На высоте венозного давления заполняются кровью вены.
В практических целях — для определения показаний к дренированию кишки, ее резекции и уточнения допустимых границ резекции кишки — мы использовали трансиллюминационную ангиотензометрию у 66 больных с механической тонкокишечной непроходимостью. Соответствие полученных данных нарушениям в микроциркуляторном ложе в 23 наблюдениях верифицировано с помощью контактной биомикроскопии. Снижение систолического давления до 40 мм рт. ст. расценивали как глубокое нарушение внутристеночной гемоциркуляции, свидетельствующее о необходимости длительного пассивного дренирования кишечной трубки и недопустимости использования данного участка кишки для наложения анастомоза. Снижение давления до 20 мм рт. ст. или полную утрату активного пульсирующего кровотока расценивали как признак сомнительной жизнеспособности кишки и в совокупности с другими признаками это служило основанием к ее резекции.
Особенно полезным оказывается использование метода трансиллюминационной ангиотензометрии для определения доступных границ резекции в случае обширного ее объема в непосредственной близости от слепой кишки. В подобной ситуации, если придерживаться стандартных установок, необходимо производить резекцию тонкой кишки вместе с правой половиной ободочной. Обоснованное объективными критериями сокращение объема резекции помогает в такой сложной тактической ситуации сохранить важный в функциональном отношении отдел толстой кишки.
Приводим следующее наблюдение.
Больная Д., 34 лет, поступила в клинику 14.06.83 г., через 2 суток от начала заболевания с выраженными признаками острой спаечной кишечной непроходимости, осложненной перитонитом.
После интенсивной предоперационной подготовки, через 2 ч 20 мин после поступления больная оперирована. При лапаротомии из брюшной полости удалено около 1 л мутной геморрагической жидкости. Выявлена спаечная непроходимость, обусловленная конгломератом петель в дистальном отделе подвздошной кишки. Кишка темно-багрового цвета, с субсерозными кровоизлияниями, отечной стенкой. На протяжении 1 м 70 см кишка расценена как нежизнеспособная. С целью определения минимально допустимых границ резекции в проксимальном и дистальном отделах выполнена трансиллюминационная ангиотензометрия. По данным измерений, в 20 см проксимальнее видимой границы нежизнеспособности систолическое АД составило 80 мм рт. ст., диастолическое — 30 мм рт. ст. В дистальном направлении на участке, расположенном в 15 см от видимой границы сомнительной жизнеспособности кишки и в 4 см от слепой кишки, систолическое и диастолическое АД оказались соответственно 60/40 мм рт. ст. Оба участка оценены как допустимая граница резекции, что позволило несколько сократить объем обширной резекции тонкой кишки, ограничив его 2 м. Наложен анастомоз по типу конец в конец в 4 см от илеоцекального угла.
При гистологическом исследовании концов удаленной кишки последние оказались жизнеспособными. Проксимальнее анастомоза выполнено дренирование тонкой кишки по Житнюку с проведением дренажной трубки до связки Трейтца.
Тяжелое послеоперационное течение. К концу 1-й недели развились признаки острого нарушения мозгового кровообращения по типу спазма сосудов, которые через 3 сут купировались. Перитонит регрессировал. Кишечный свищ самостоятельно закрылся к концу 3-й недели. Выписана на 24-е сутки в удовлетворительном состоянии.
Обсуждая представленное наблюдение, хотелось бы обратить внимание на несколько обстоятельств.
Во-первых, сокращение объема резекции кишки по сравнению с принятыми стандартами (30—40 см в проксимальном и 15—20 см в дистальном направлении от видимых границ нежизнеспособности) допустимо лишь при наличии серьезных оснований (в данном случае — обширность резекции) и требует использования дополнительных объективных критериев оценки жизнеспособности стенки кишки в зоне резекции.
Во-вторых, краткого обсуждения требует расположение трубки, дренирующей тонкую кишку, по отношению к анастомозу. Этот вопрос не решен окончательно и не регламентирован четкими указаниями в литературе. Главная задача состоит в дренировании приводящего отдела тонкой кишки для ее декомпрессии и снижения нагрузки на анастомоз. Это может достигаться введением трубки выше уровня анастомоза (как было сделано в представленном наблюдении), интубацией приводящих отделов через гастростому или с помощью назоинтестинального зондирования или же ретроградным проведением трубки через анастомоз с выведением ее ниже уровня соустья через энтеростому или цекостому. Мы произвели резекцию тонкой кишки с дренированием ее и наложением первичного межкишечного соустья у 66 больных. У 37 дренажная трубка проходила через соустье, у 29 — располагалась проксимальнее анастомоза. В первой группе несостоятельность швов отмечена у 2 больных, во второй — у одного. Таким образом, достоверно судить о преимуществах того или иного способа вряд ли допустимо.
Что касается вида кишечного соустья, то при отсутствии специальных противопоказаний предпочтение следует отдавать анастомозу по типу конец в конец как более физиологичному. При этом умеренно выраженное несоответствие поперечных размеров приводящего и отводящего отрезков кишки легко устраняется за счет косого среза или просто рассечения отводящей, кишки по антибрыжеечному краю. По нашим данным, у 264 больных (81,6% от всех резекций тонкой кишки с наложением первичного анастомоза) соустье выполнено по типу конец в конец, у 42 (16,2%) —по типу бок в бок и у 6 больных (2,2 %) произведено наложение илеотрансверзоанастомоза по типу конец в бок после резекции подвздошной кишки с ушиванием наглуго дистального ее отрезка.
Хирургическая тактика при резекции дистального отдела подвздошной кишки в непосредственной близости от илеоцекального угла не однозначна. Ряд авторов [Литтман И., 1970; Астапенко В. Г., 1982, и др.] рекомендуют короткий периферический отрезок погружать в слепую кишку, а непрерывность кишечной трубки восстанавливать илеотрансверзоанастомозом. Другие хирурги |Дыскин Е. А.,1958, 1961; Сапаров И. Н., 1965, 1973; Земляной А. Г. и др., 1983; Cosnes J. et al., 1978, и др.], наоборот, стремятся сохранить правую половину ободочной кишки как имеющую важное физиологическое значение. Это значение определяется замыкательной функцией илеоцекального клапана, препятствующего обратному поступлению содержимого толстой кишки в, тонкую, а также наличием аппарата лимфоидных образований, играющих чрезвычайно важную роль в формировании иммунитета.
На основе литературных данных и данных собственных анатомо-функциональных исследований мы убедились в целесообразности сохранения этой важной в функциональном отношении зоны пищеварительной системы [Серова Л. С., 1987]. При этом оказалось, что встречающиеся иногда рекомендации выключения илеоцекального угла, основанные на суждениях о ненадежности кровоснабжения дистальных 12—15 см подвздошной кишки при ее резекции и об опасности наложения кишечного соустья с коротким отрезком подвздошной кишки, следует воспринимать критически. Действительно, на удалении 12—18 см от слепой кишки у ряда индивидуумов сосудистая аркада подвздошной кишки выражена недостаточно и в этом случае можно говорить о так называемой «критической зоне». Однако терминальный отдел подвздошной кишки на расстоянии 8—10 см от слепой кишки, как правило, хорошо снабжается кровью из подвздошно-ободочной артерии.
В клинике выполнено 45 резекций подвздошной кишки в непосредственной близости (10 см и менее) от слепой кишки. У 31 больного операция закончена формированием термино-терминального анастомоза с короткой культей подвздошной кишки (от 4 до 8 см), а у 14 больных наложен илеотрансверзоанастомоз с ушиванием наглухо терминального отдела подвздошной кишки. В первой группе несостоятельность анастомоза возникла у 2 больных, во второй — у 5. Кроме того, у отдельных больных второй группы при изучении отдаленных результатов отмечены жалобы, которые могут быть расценены как проявление дисфункции в зоне анастомоза.
Таким образом, уже сейчас можно говорить о допустимости наложения соустья с терминальным отделом подвздошной кишки, если предварительно убедиться в достаточности его кровоснабжения.
Сложными являются вопросы хирургической тактики и ведения послеоперационного периода у больных с проксимальными или дистальными обширными (субтотальными) резекциями тонкой кишки. При механической тонкокишечной непроходимости объем резекции тонкой кишки нередко достигает 50 % общей ее длины, что по современным представлениям трактуется как обширная резекция [Даиров А. Б., 1970; Элькин М. А.,1970; Butler D., 1959; Alexandre Н., 1970], а у ряда больных превышает 75—80 % общей длины тонкой кишки, что расценивается как субтотальная ее резекция. По нашим данным, при острой механической кишечной непроходимости обширная резекция кишки была выполнена у 79 больных, в том числе до 2 м — у 66 и от 2 до 3 м — у 13. Субтотальную резекцию тонкой кишки пришлось выполнить 12 больным.
Необходимость выполнения обширных и субтотальных резекций тонкой кишки возникает при операциях по поводу наиболее тяжелых запущенных форм острой кишечной непроходимости. В связи с этим главной причиной смерти в раннем послеоперационном периоде являются перитонит и эндогенная интоксикация, связанные с основным заболеванием и тяжелой операционной травмой. У перенесших начальную фазу послеоперационного периода больных нарушение процессов пищеварения и всасывания приводит к развитию тяжелого и опасного патологического состояния, обозначаемого в литературе как «синдром короткого кишечника» [Tilson М., Wright Н., 1972]. В наших исследованиях особое внимание было уделено изучению патогенеза и возможности корригирующего лечения этого синдрома. При этом установлено, что при проксимальной резекции 80 % тонкой кишки достоверно снижается всасывание продуктов расщепления альбумина.
При дистальных обширных резекциях нарушается всасывание наиболее энергоемких жирных продуктов, проявляется послабляющий эффект невсосавшихся жиров и убедительно снижается общий объем лимфообразования.
В то же время всасывание глюкозы не претерпевало существенных изменений при любом варианте вмешательства.
Проведенные экспериментальные исследования позволили также дать оценку некоторым вариантам корригирующих оперативных вмешательств, рекомендуемых при обширных и суфотальных резекциях тонкой кишки. Так, несколько лучшие показатели резорбции белковых продуктов при проксимальной обширной резекции были получены при выполнении анастомоза по типу конец в конец по сравнению с анастомозом бок в бок. Такое положение связано с сохранением большей площади контакта продуктов с активной пищеварительной поверхностью тощей кишки. Наоборот, при обширной дистальной резекции более выгодным оказалось создание соустья по типу бок в бок, что, по- видимому, является следствием некоторой задержки пассажа в раннем послеоперационном периоде при данной конструкции кишечного соустья.
Полученные экспериментальные данные нашли подтверждение при исследовании всасывания альбумина, меченного, у 5 больных, перенесших обширные и субтотальные резекции тонкой кишки. Обнаружено достоверное снижение уровня продуктов расщепления меченого белка в периферической крови и изменение характера кривой всасывания белка по сравнению с нормой. Одновременно у этих больных было выявлено повышенное содержание радиоактивного белка в кале в зависимости от объема резекции. Наблюдалась взаимосвязь между нарушением всасывания белковых продуктов и исходом лечения.
Результаты экспериментально-клинического изучения функциональных последствий обширных и субтотальных резекций тонкой кишки позволили разработать основные требования к ведению послеоперационного периода у больных, перенесших подобные операции.
Первые 3—5 сут больным после обширных резекций тонкой кишки проводят лечение в соответствии с характером основного заболевания и травматичностью хирургической операции. Корригируют водно-электролитные нарушения, устраняют последствия катаболизма белков осуществляют антибактериальную и антикоагулянтную терапию. Начиная с 4 — 5 сут.больных постоянно переводят на энтеральное питание. Парентеральное питание при этом сохраняется и служит дополнительным источником энергетических и пластических резервов. Энтеральное питание органичивают в объеме разовой дозы, а прием пищи учащается до 8—10 раз в день. Из пищевых продуктов при проксимальной резекции на начальном этапе дают до 10—15 г в сутки жиров и цельного молока, а при дистальной обширной резекции эти продукты в послеоперационном периоде совсем исключают из рациона. Применение фестала и панзинорма до 6 раз в день во время приема пищи позволяет уже в начальном периоде сократить число дефекаций до 3—4 раз в сутки и улучшает характер стула. Для профилактики бактериальных энтеритов за счет смещения в проксимальные отделы тонкой кишки «дистальной» микрофлоры назначают внутрь антибиотики (оксациллин, левомицетин и др.). В этот период осуществляется строгий контроль за содержанием гемоглобина, общего белка и его фракций, калия, натрия, кальция, магния, хлора, за активностью аланин-аминотрансферазы и аспартатаминотрансферазы, щелочной фосфатазы, а также содержанием билирубина. Эти лабораторные показатели в течение 1-го месяца после операции исследуют не реже одного раза в неделю, а в течение первого года после операции — не реже одного раза в месяц. В такие же сроки исследуют копрограмму.
Парентеральную терапию планируют в зависимости от клинических данных и лабораторных показателей: проводят переливания крови, плазмы, белковых и аминокислотных препаратов, жировых эмульсий, концентрированных растворов глюкозы, полиионных солевых растворов, применяют витамины. Сроки перевода на полное энтеральное питание определяют индивидуально, равно как и сроки выписки из стационара. В наших наблюдениях у данной категории больных сроки выписки составили от 2 до 8 нед.
После выписки больные в течение 2—3 лет должны находиться под постоянным наблюдением гастроэнтеролога, знающего существо и проявления синдрома «короткого кишечника». При выраженных клинических и лабораторных отклонениях показана повторная госпитализация таких больных для корригирующего лечения. Весь этот период больным рекомендуется прием ферментативных препаратов (фестал, панзинорм) до 2—3 раз в день и поливитаминов. В пищевом рационе ограничиваются жиры и цельное молоко.
Лечение больных после обширных и субтотальных резекций представляет сложную, трудоемкую, но отнюдь не бесперспективную задачу.
Наблюдения.
Больной Е,. 40 лет, поступил в клинику 19. 06. 79 г. с выраженными признаками ущемленной правосторонней косой паховой грыжи с явлениями кишечной непроходимости. После предоперационной подготовки в течение 50 мин больной оперирован. Под эндотрахеальным наркозом косым паховым доступом обнажен и вскрыт грыжевой мешок. Удалено до 50 мл прозрачного выпота. В грыжевом мешке располагались две тонкокишечные петли темно-синюшного цвета. Произведена широкая герниолапаротомия с рассечением ущемляющего кольца. В брюшной полости содержалось до 500 мл прозрачного геморрагического выпота. Между двумя ущемившимися кишечными петлями имелось ретроградное ущемление большей части тонкой кишки, расположенной на длинной брыжейке. Ущемленная часть кишки темно-багрового цвета. Пристеночные сосуды брыжейки не пульсировали. Ущемленная кишка признана нежизнеспособной. Произведена резекция 380 см тонкой кишки с сохранением 70 см тощей кишки и 6 см подвздошной. Наложен анастомоз по типу конец в конец в 5 см от слепой кишки. Таким образом, объем операции соответствовал дистальной субтотальной резекции. В послеоперационном периоде в полном объеме проводили профилактические и лечебные мероприятия в соответствии с принятой в клинике программой ведения больных с обширной и субтотальной резекцией тонкой кишки. Существенных осложнений не отмечено. К моменту выписки частота стула сократилась до 3 -4 раз в сутки. Потеря массы тела за период пребывания в стационаре составила около 6 кг.
После выписки больной наблюдался в течение 2 лет. Дважды, через 3 мес. и через 7 мес. поступал в клинику для обследования и корригирующей терапии. К концу периода наблюдения дефицит массы тела стабилизировался на уровне 7—8 кг. Частота стула при соблюдении диеты до 3—4 раз в сутки. Инвалид II группы.
Представленное наблюдение, как и другие аналогичные случаи, иллюстрирует тяжесть нарушений, связанных с обширной резекцией тонкой кишки, но в то же время убедительно показывает широкий диапазон адаптационных возможностей человеческого организма. Изучение и целенаправленное использование этих возможностей составляют одну из задач применительно к лечению больных, оперированных по поводу различных форм острой тонкокишечной непроходимости.